numere cuantice - studopediya
Fiecare valoare corespunde l anumită formă orbitală. ecuația Schrödinger arată că s-orbital (l = 0), are o formă sferică, p-orbital (l = 1) - (. Figura 2.1) o formă dumbbell etc. ...
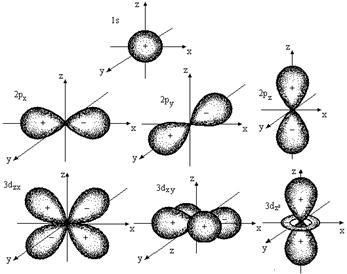
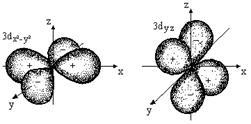
Fig. 2.1. Forme de orbitali atomici
Pentru electroni, primul nivel de energie (n = 1), este posibilă doar o singură formă de orbitali (e), pentru al doilea (n = 2) - două (s și p), etc. Astfel, nivelurile de energie sunt compuse din unul sau mai multe subnivele energie .. . Pentru n = 1 există doar un sub-strat cu l = 0, pentru n = 2 - doi și l = 0 și l = 1 și așa mai departe.
Stat de un electron dintr-un atom reprezintă numere și litere. De exemplu, un electron care n = 1 si l = 0, reprezintă 1s. 4p condiție înseamnă că energia electronilor este pe al patrulea nivel (n = 4); corespunde formei orbitali halteră (l = 1), etc.
Numărul cuantic magnetic (m) - caracterizează orientarea spațială a orbital. Aceasta depinde de numărul cuantic orbital și presupune valori de la -l la zero și de la zero la + l. De exemplu, dacă numărul cuantic orbital este 0 (s-orbital), atunci numărul cuantic magnetic are o valoare (0), dacă numărul cuantic orbital este 1 (p orbital), atunci numărul cuantic magnetic are trei valori: -1, 0, și 1, și dacă numărul cuantic orbital este 2 (d-orbital), atunci numărul cuantic magnetic are cinci valori: -2, -1, 0, +1 și +2 etc. Astfel, pentru fiecare valoare a lui l are valori (2l + 1) de m.
Toate orbitali un subnivel l au aceeași energie, dar în mod diferit unul față de altul (figura 2.1) orientată.
O astfel de stări cuantice de electroni sunt numite degenerat degenerate triply p-stat, d-condiție - de cinci ori, etc. (Tabelul 2.3.).
Subnivele și orbitali atomici
Studiul spectrelor atomice a arătat că trei numere cuantice insuficiente pentru a descrie proprietățile electronilor.
al patrulea număr suplimentar de cuarci cuantic de spin (e) ( „centrifugare“ - rotatie, ax) - caracterizează momentul cinetic mecanică intrinsecă a mișcării de electroni, care reprezintă în mod convențional rotație în jurul propriei sale axe. Ea poate avea loc în două direcții opuse. Prin urmare, numărul cuantic de spin are doar două valori: + 1/2 și - 1/2. Prezența spinul electronului a fost confirmată experimental. Electronii cu diferite spini sunt indicate prin săgeți îndreptate în sus și în jos.