Ceea ce este diferit de aburul nesaturat, saturat, care este diferența
Înainte de a răspunde la întrebarea pusă în titlu, vom înțelege că această pereche. Imagini, rezultând în cele mai multe persoane cu acest cuvânt: ibric sau cratiță, baie de aburi, o băutură caldă, și multe alte astfel de imagini de fierbere. Oricum, în ideile noastre prezente lichide și substanță gazoasă care se ridică deasupra suprafeței sale. Dacă vi se cere să dea un exemplu de cuplu, vei gândi imediat de vapori de apă, vapori de alcool, eter, benzen, acetonă.

Există un alt cuvânt pentru a descrie starea gazoasă - gazul. Aici ne amintim, de obicei, oxigen, hidrogen, azot și alte gaze, fără asocierea lor cu lichidele respective. În acest caz, este bine cunoscut faptul că acestea există într-o stare lichidă. La prima vedere, diferențele constau în faptul că perechile corespunde fluidele naturale, și este necesar să se lichefieze gazele în mod specific. Cu toate acestea, acest lucru nu este în întregime adevărat. Mai mult decât atât, imaginile rezultate din perechile de cuvinte - feribot nu sunt. Pentru a da un răspuns mai precis, ne uităm la modul în care cuplurile de acolo.
Diferitele perechi de gaz?
Fizică substanță stare de temperatură dată, mai precis relația dintre energia la care interacționează molecula și energia mișcării lor termice aleatoare. Aproximativ, putem presupune că dacă energia de interacțiune este mult mai mult - starea solidă, în cazul în care mult mai multă energie de mișcare termică - gazoasă, în cazul în care energia comparabil - lichid.
Se pare că molecula ar putea desprinde din lichid și să participe la formarea de abur și energie termică trebuie să fie mai mare decât energia de interacțiune. Cum se poate întâmpla acest lucru? Viteza medie a mișcării termice a moleculelor este egală cu o anumită valoare în funcție de temperatura. Cu toate acestea, molecule individuale de viteze diferite: cele mai multe dintre ele au viteze apropiate de media, dar unele porțiuni este mai mare decât rata medie, un anumit - mai puțin.
Cu cât mai repede moleculele pot avea o energie termică mai mare decât energia de interacțiune, ceea ce înseamnă că lovește suprafața unui lichid, sunt capabili să-l pună jos, formând perechi. Un astfel de proces se numește vaporizarea evaporare. Datorită există aceeași distribuție a vitezei și procesul invers - condensare: moleculele din vaporii unui lichid. imagini De altfel, care apar de obicei atunci când vaporii cuvântul nu este abur, ca urmare a procesului opus - condensare. Cuplurile care nu pot fi văzute.

Steam în anumite condiții pot fi fluide, dar temperatura nu trebuie să depășească o anumită valoare. Această valoare se numește temperatură critică. Vaporii și gazele - stare gazoasă, caracterizată prin temperatura la care acestea există. Dacă temperatura nu depășește critice - perechi, dacă depășesc - gaz. Dacă vă păstrați temperatura constantă și de a reduce volumul de abur - gaz lichefiat - nu lichefiat.
Ce este abur saturat și nesaturat
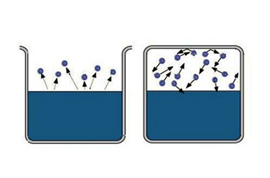
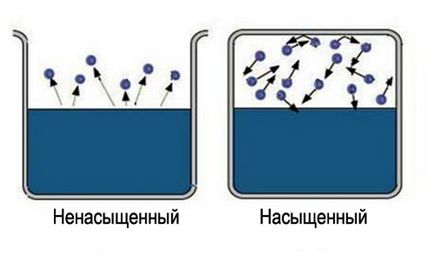
Cuvântul „bogat“ are unele informații, este dificil de a satura o regiune mare de spațiu. Deci, pentru a obține aburul saturat, este necesar să se limiteze spațiul în care lichidul. Temperatura trebuie să fie astfel mai puțin critică pentru un anumit material. Acum moleculele vaporizate rămân în zona în care lichidul este. În primul rând, majoritatea moleculelor tranzițiilor va avea loc din lichid, densitatea vaporilor este crescută. Acest lucru, la rândul său, va provoca un număr mai mare de tranziții inverse ale moleculelor in lichidul care va crește rata de condensare.
În cele din urmă, un stat este stabilit astfel încât numărul mediu de molecule care trec de la o fază la alta vor fi egale. Aceasta se numește echilibru dinamic. Această stare este caracterizată printr-o modificare egală în mărimea și direcția ratelor de evaporare și condensare. Această stare corespunde aburului saturat. Dacă se ajunge la starea de echilibru dinamic, acest lucru corespunde unui abur nesaturat.
Începe să studieze un obiect, întotdeauna cu cea mai simplă a modelului său. În teoria moleculară-cinetică este - un gaz ideal. Principala simplificare este - neglija propriul său volum de molecule și energiile lor de interacțiune. Se pare că acest model descrie în mod satisfăcător de abur nesaturat. Mai mult, cu atât mai puțin este saturată, legalitatea aplicării sale. Ideal de gaz - un gaz, nu poate deveni fie abur sau lichid. Prin urmare, aburul saturat, acest model nu este adecvat.
Principalele diferențe față de vaporii nesaturați
- Saturate înseamnă că obiectul are cea mai mare valoare posibilă a unor parametri. Abur - este densitatea și presiunea. Acești parametri pentru vaporii nesaturați au valori mai mici. Mai departe de vaporii de saturație, cea mai mică valoare. O precizare: compararea temperaturii trebuie să fie constantă.
- Pentru abur nesaturat este realizată legea lui Boyle. dacă temperatura și masa de gaz este constantă, creșterea sau scăderea volumului determină o scădere sau creștere a presiunii cu același factor, presiunea și volumul - legat invers proporțional. Deoarece densitatea maximă și presiunea la o temperatură constantă implică faptul că acestea sunt independente de volumul de vapori, se pare că pentru presiunea vaporilor saturate și volumul - sunt independente unul față de celălalt.
- Pentru Densitatea vaporilor nesaturate nu depinde de temperatură. iar în cazul în care volumul este stocat, nu se schimba densitatea. Pentru abur saturat, menținând densitatea de volum variază atunci când se schimbă temperatura. Dependența în acest caz linia. Dacă temperatura crește, crește densitatea și când temperatura scade, densitatea de asemenea modificări.
- Dacă volumul este constant, vaporii nesaturați se comportă conform legii lui Charles: când temperatura crește cu aceleași creșteri ale factorului și presiunea. Această dependență se numește liniară. La o presiune a vaporilor saturați cu creșterea temperaturii crește mai repede decât vaporii nesaturați. Dependența este exponențială.
Pentru a rezuma, au existat diferențe semnificative în proprietățile obiectelor comparate. Principala diferență este că cuplurile într-o stare de saturație, nu poate fi separat de lichidul său. Acest sistem cu două componente, în care este imposibil să utilizați majoritatea legilor de gaz.