Cum de a calcula procentul de greutate
Procentajul masei definește procentul de elemente dintr-un compus chimic. [1] Pentru a determina procentul de greutate este necesară cunoașterea masei moleculare (grame per mol) incluse în elementele de conectare sau numărul de grame din fiecare componentă necesară pentru a obține o soluție dată. [2] Procentul în greutate calculat destul de simplu: este suficient să se împartă elementul de masă (sau o componentă) față de greutatea tuturor compusului (sau soluție).
pași Editare
Metoda 1 de la 2:
Determinarea procente în greutate dintr-o anumită masă Editare


- La începutul rezolvării problemei, se înregistrează greutatea egalitatea procentuală = (greutatea componentei / greutatea totală a compusului) x 100.
- Masa componentei de interes ar trebui să fie în problema. În cazul în care nu este dat masa, du-te la următorul capitol, în care a vorbit despre modul în care să se determine procentajul din greutatea masei necunoscute.
- Masa totală a compusului chimic se obține prin adăugarea masele tuturor elementelor (componente) care fac parte din acest compus (sau soluție).
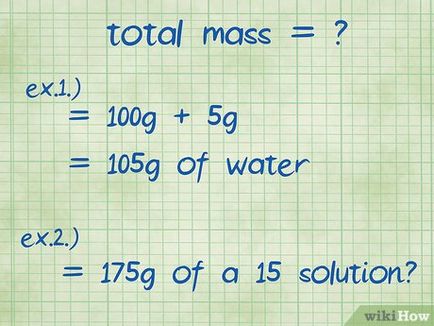
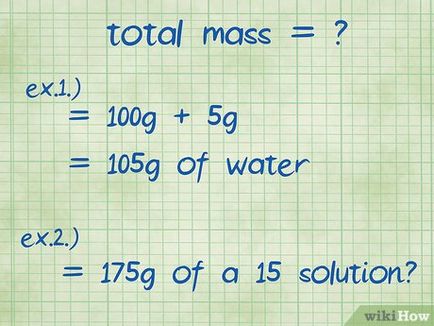
- Exemplul 1: Care este procentul în greutate de 5 grame de hidroxid de sodiu dizolvat în 100 g de apă?
- Greutatea totală a soluției este suma cantităților de hidroxid de sodiu și apă: 100 g + 5 g da 105 g
- Exemplul 2: Cât de clorură de sodiu și apă necesară pentru a produce 175 g soluție 15 procente?
- În acest exemplu, având în vedere masa totală și procentul necesar, și doriți să găsiți numărul de substanțe care urmează să fie adăugate la soluția. Greutatea totală este de 175 de grame.


- Exemplul 1: O masă predeterminată de componente - hidroxid de sodiu - este de 5 grame.
- Exemplul 2: În acest exemplu o anumită greutate componentă este necunoscută, și ar trebui să fie găsit.
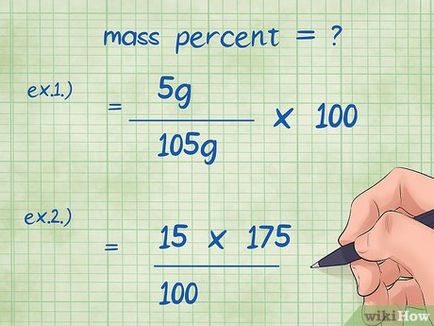
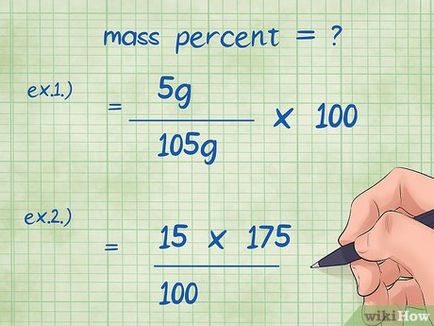
- Exemplul 1: procente în greutate = (component greutate / masa totală a compusului) x 100 = (5 g / 105 g) x 100.
- Exemplul 2. trebuie convertit într-un procent formula de greutate, astfel încât să fie capabil să găsească masa necunoscută a componentei chimice: component = masa (procent de masă din masa totală a compusului *) / 100 = (15 * 175) / 100.
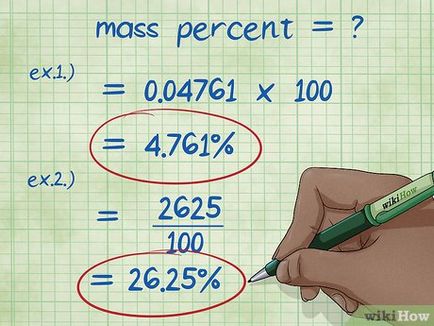
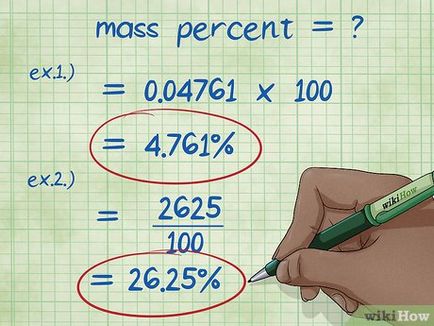
- Exemplul 1: (5/105) x 100 = 0,04761 x 100 = 4.761%. Astfel, procentul în greutate de 5 grame de hidroxid de sodiu dizolvat în 100 g de apă este de 4.761%.
- Exemplul 2: Expresia este rescris pentru componenta procente de masă este (procent de greutate din masa totală a substanței *) / 100, unde găsim: (15 * 175) / 100 = (2625) / 100 = 26,25 grame de clorură de sodiu.
- Cantitatea necesară de apă se obține prin scăderea greutății componentelor din greutatea totală a soluției: 175 - 26.25 = 148,75 grame de apă.
Metoda 2 din 2:
Determinarea procentului de masă, atunci când masele nu sunt setate Editare


- La începutul rezolvării problemei, înregistrează procentul în greutate egalitate = (masa molară a elementului / greutatea moleculară totală a compusului) x 100.
- Ambele valori sunt măsurate în grame per mol (g / mol).
- Daca nu sunt date în greutate, procentul de greutate a unei componente într-o anumită problemă poate fi găsit folosind masa molară.
- Exemplul 1: Găsiți procentul în greutate de hidrogen în molecula de apă.
- Exemplul 2: Găsiți procentul masic de carbon în molecula de glucoza.


- Exemplul 1: formula chimică record de apă, H2O
- Exemplul 2: Glucose formulă chimică scriere, C6 H12 O6.


- Exemplul 1: găsi masa molară de oxigen (15.9994) și hidrogen (1.0079). [9]
- Exemplul 2: găsi masa molară de carbon (12.0107), oxigen (15.9994) și hidrogen (1.0079).
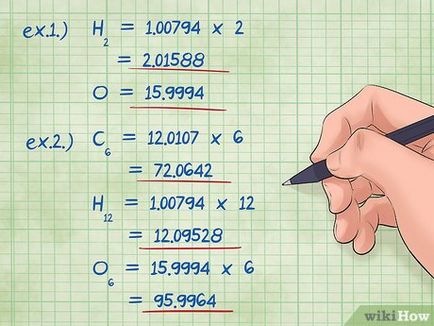
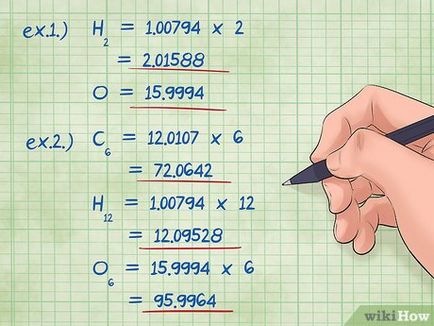
- Exemplul 1: un simbol de hidrogen este 2, iar sub simbolul oxigen 1 (echivalent cu absența). Astfel, masa molară a hidrogenului trebuie multiplicată cu 2: 1,00794 X 2 = 2.01588; masa molară de oxigen rămâne aceeași, 15.9994 (adică, înmulțit cu 1).
- Exemplul 2: standuri simbol 6 carbon în atmosferă de hidrogen 12 și oxigen sub 6. Multiplicarea elemente de masă molar pe aceste cifre, găsim:
- carbon: (12.0107 * 6) = 72.0642
- hidrogen: (1.00794 * 12) = 12.09528
- oxigen: (15.9994 * 6) = 95.9964
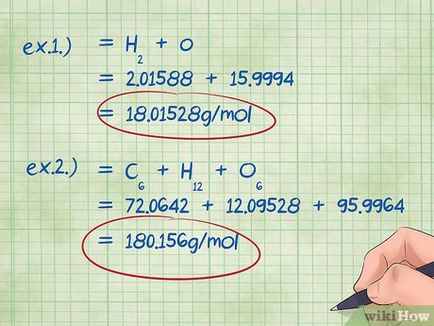
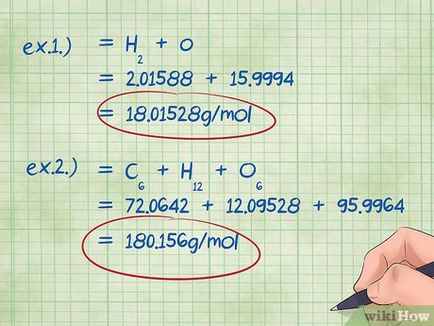
- Exemplul 1: se adaugă la 2.01588 g / mol (masa de doi moli de atomi de hidrogen) 15.9994 g / mol (greutate de un mol de atomi de oxigen), ca rezultat, se va 18.01528 g / mol.
- Exemplul 2 ori mase molare rezultate: carbon + hidrogen + oxigen = + 12.09528 + 72.0642 95.9964 = 180.156 g / mol.
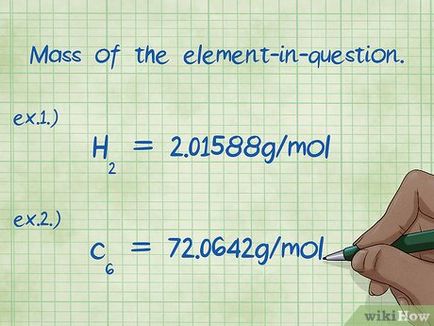
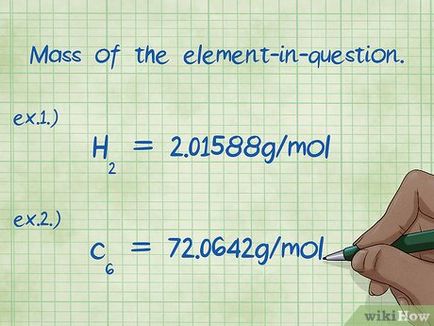
- Exemplul 1: Masa hidrogenului din compusul este 2.01588 g / mol (masa de doi moli de atomi de hidrogen).
- Exemplul 2: masa de carbon din compusul este 72.0642 g / mol (moli de masă șase atomi de carbon).


- Exemplul 1: procente în greutate = (element de masă molară / compus cu greutate moleculară totală) x 100 = (2,01588 / 18,01528) x 100.
- Exemplul 2: procente în greutate = (element de masă molară / compus cu greutate moleculară totală) x 100 = (72,0642 / 180.156) x 100.
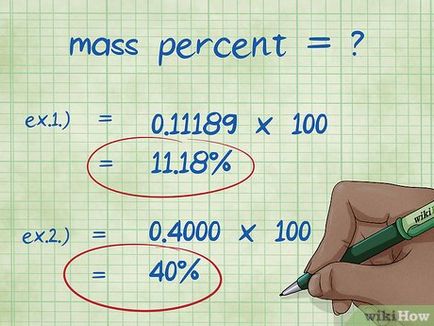
- Exemplul 1: procente în greutate = (element de masă molară greutate moleculară / totală a compusului) x 100 = (2,01588 / 18,01528) x 100 = 0,11189 x 100 = 11.18%. Astfel, procentul de greutate a atomilor de hidrogen dintr-o moleculă de apă este egală cu 11,18%.
- Exemplul 2: procente în greutate = (element de masă molară greutate moleculară / totală a compusului) x 100 = (72,0642 / 180.156) x 100 = 0,4000 x 100 = 40,00%. Astfel, procentul de greutate al atomilor de carbon din molecula de glucoză este 40,00%.