Determinarea constanta universală a gazelor
dispozitive si accesorii necesare. Balonul de sticlă
având două degete, o pompă de apă Komovskogo manometru.
Toate corpurile, solide, lichide și gazoase, efectua munca
cu orice modificare a volumului. Luați în considerare acest exemplu:
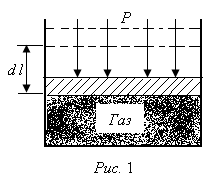
Imaginați-vă că gazul închis într-un cilindru cu un montaj etanș un piston mobil având o suprafață fără greutate
Să presupunem că gazul acționează presiunea atmosferică doar P- exterior. Parametrii inițiali ai stării de gaz este notat. Să presupunem că primul gaz este în echilibru cu presiunea externă. Dacă nu la gaz de căldură. se va încălzi și presiunea crește.
începe de gaz foarte lent (reversibil) să se extindă până când presiunea gazului este echilibrată cu presiunea externă, extinderea liber, adică. E. P = const. Piston peremeschyaetsya cu o distanță suficient de mică ca presiunea gazului poate fi considerată în timpul procesului de expansiune intact. Gazul acționează asupra pistonului cu puterea și efectuează lucrările de expansiune pe piston
Astfel, obținem expresia (2)
Aici, o lucrare elementară făcut în timpul expansiunii gazului și nu este differetsialom completă (această valoare nu este o funcție a statului), - incrementul volumului de gaz.
Atunci când extinderea în examinare volum (solid, lichid sau gazos) increment pozitiv respectiv și pozitiv corp. Atunci când corpul este comprimat în negativ, respectiv, și negative.
Ecuația (2) definește o operație elementară efectuată când infinitezimal volumului increment. Munca depusă la schimbarea finală în volum se calculează prin însumarea activitatea elementară, și anume de intergirovaniya:
Acolo - activitatea desfășurată de către organism atunci când schimbarea volumului corpului valorii la valoarea.
Equilibrium protsessy- acest proces care constă dintr-o secvență de stări de echilibru. Ei curg, astfel încât schimbarea parametrilor termodinamici într-o perioadă scurtă de timp este minim. Toate procesele reale nu sunt în echilibru. Dar, mai degrabă lent proces procedând poate fi considerat de echilibru. procesele Equilibrium pot fi grafic. De exemplu,
schimbări de proces, în volum a corpului poate fi reprezentat în planul fazelor
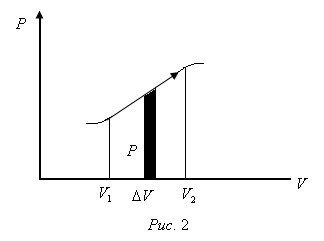
Ecuația (3) conduce activitatea desfășurată de gaz la diferite izoprotsessah. Găsim activitatea desfășurată de un mol de gaz sub expansiune izobară datorită încălzirii cu un grad Kelvin.
Presiunea rămâne constantă în timpul procesului de izobară. Graficul acestui proces (izobară) și în coordonatele reprezentate printr-o linie dreaptă, paralelă cu axa V. Atunci când gazul de lucru proces izobară (3) din volumul de expansiune este egal cu
Funcționarea (4) determinat de aria dreptunghiului pe.
Dacă utilizați Clapeyron Mendeleev, am ales două stări de un mol de gaz, putem scrie:
Apoi, expresia (4) pentru extinderea izobară ia forma
Dacă, atunci = 1 mol de gaz:
Din aceasta aflăm că constanta universală a gazelor este numeric egal cu expansiunea izobară de 1 mol de gaz prin încălzire pe.
Pentru o expresie de masă gaz arbitrar (8) are forma
Punând, numărul de moli de unitate obține constanta de gaz