Proprietățile metalice și nemetalice ale elementelor chimice
a) Legile referitoare la proprietățile nemetalice ale elementelor metalice și.
1. Atunci când se deplasează de la dreapta la stânga de-a lungul proprietatile elementului metalic de epocă îmbunătățite. În direcția opusă crește nemetalic.
De la stânga la dreapta într-o perioadă, de asemenea, a crescut, iar sarcina nucleului. Prin urmare, creșterea gradului de atractivitate a electronilor de valență de bază și a împiedicat reculul lor.
2. Atunci când se deplasează de-a lungul grupurilor de sus în jos elementele de armare din metal proprietăți. Acest lucru se datorează faptului că mai jos Grupul sunt elemente care au coji de electroni deja destul de mult umplut. cochilii exterioare sunt mai departe de nucleu.
b) Legile proprietăți redox aferente. Modificări în elemente electronegativitate.
1. STÂNGA DREAPTA consolida proprietățile oxidante, și în mișcare în jos - reducerea elementelor proprietăți.
2. Electronegativitatea crește, de asemenea, la stânga la dreapta. ajungând la halogeni.
3. Dacă mutați în partea de sus în jos scade grupului electronegativitate. Acest lucru se datorează unei creșteri a numărului de coji de electroni, dintre care ultima electronii sunt atrași de nucleul tuturor slăbind.
c) Legile referitoare la dimensiunile atomilor.
1. Dimensiunile atomilor (raza atomică), atunci când se deplasează la stânga la dreapta de-a lungul scăderilor perioadei.
2. Atunci când se deplasează cu raza atomică TOP-DOWN a elementelor GROW. deoarece este umplut cu mai multe scoici electronice.
Structura materiei. hibridizarea Orbital. Tipurile de legături chimice. Potențialul de ionizare și electronegativitatea.
Toate corpurile constau din particule individuale - molecule și atomi. Molecule - este cele mai mici particule de materie. Moleculele constau din atomi.
Informații de bază despre compoziția substanței:
1) Toate corpurile constau din particule individuale (atomi și molecule) între care există lacune.
2) Moleculele se mișcă în mod continuu și haotic.
3) Moleculele interacționează (atrag și se resping).
1) moleculele aceleași substanțe sunt identice.
2) La încălzire, golurile dintre moleculele crește, și sub răcire - scădere.
3) Pe măsură ce temperatura crește, viteza moleculelor crește.
În funcție de tipul de structură toate substanțele sunt împărțite în moleculara si non-moleculare. Dintre substanțele organice predomină substanțele moleculare includ anorganice - nonmolecular.
În funcție de tipul de agenți lianți chimici sunt împărțite în legături covalente cu substanța, substanța cu legături ionice (substanțe ionice) și substanțe cu legături metalice (metale).
Substanțele cu legături covalente pot fi moleculare și non-moleculare. Acest lucru afectează în mod semnificativ proprietățile lor fizice.
Substanțe moleculare compuse din molecule legate între ele prin legături intermoleculare slabe, acestea includ: H2. O2. N2. Cl2. Br2. S8. P4 și alte substanțe simple; CO2. SO2. 2O 5. H2O, HCl, HF, NH3. CH4. C2 H5 OH, polimeri organici si multe alte substante. Aceste substanțe nu au o rezistență ridicată, au puncte de topire și de fierbere scăzute, nu conduc electricitate, dintre care unele sunt solubile în apă sau alți solvenți.
substanță Nonmolecular legat covalent sau substanță atomică formează cristale foarte puternice (excepție - grafit stratificat) (Diamond, grafit, Si, SiO2 SiC, etc.), acestea sunt insolubile în apă și alți solvenți au topire ridicat și cu punct de fierbere, cele mai multe dintre ele nu conduce curentul electric (cu excepția grafitul cu conductivitate și semiconductori - siliciu, germaniu, etc.).
Toate substanțele ionice sunt în mod natural non-molecular. Acest solid refractar substanțe, soluții și care se topește conduc curentul electric. Multe dintre ele sunt solubile în apă.
hibridizarea Orbital - o schimbare in forma unor orbitali în formarea unei legături covalente pentru a realiza o mai bună suprapunere de orbitali.
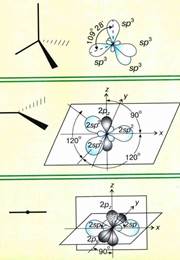
sp 2 - hibridizare. Un orbitală s- și P- orbitali două transformate în trei orbitali identice „hibrid“, unghiul dintre axe este egală cu 120 °.
Molecule în care sp 2 - hibridizare, au o geometrie planară.
hibridizarea SP-. Un orbitală s- și p- una orbitală transformată în două orbitali identice „hibrid“, unghiul dintre axe este egală cu 180 °. Molecule în care hibridizarea SP-au o geometrie liniară.
Tipurile de legături chimice.
1) Ion (metal + metaloid)
2) covalentă (+ metaloid metaloid prin perechi de electroni partajate)
Tipuri: * polare (diferite nemetale)
* Non nepolari (aceleași nemetale)
Tipuri: * a stabilit mecanismul de schimb
* Stabilit un mecanism donor-acceptor
Mecanismul de schimb - în formarea unei legături care implică orbitali atomici one electron, adică Fiecare atom oferă o utilizare obișnuită a unui singur electron:
Mecanismul donor acceptor (legătură coordonare) - legătura chimică dintre doi atomi sau grupe de atomi, efectuat datorită perechii de electroni unshared unui atom (donor) și un orbital liber al unui alt atom (acceptor).
3) metalic (între atomii de metal între ionii metalici și electroni liberi partajate)
4) hidrogen (hidrogen între o moleculă și un alt element de mai electronegative (O, S, N, F) și cu o altă moleculă)
Potențialul de ionizare al atomului - minim potențial U. diferență care trebuie să treacă într-un electron accelerare câmp electric, în scopul de a dobândi suficientă energie cinetică pentru ionizarea atomilor.
Electronegativitate (EO) - capacitatea relativă de a atrage electroni de atomi în legarea cu alți atomi. Electronegativitate caracterizează capacitatea unui atom la polarizarea legăturilor chimice.