Proprietățile chimice ale alcanilor
Alcanii sunt chimic substanțe relativ inerte. Ei nu interacționează cu reactivii care reacționează ușor cu alchene sau alchine. Hexan, de exemplu, nu este modificat prin acțiunea acidului sulfuric concentrat, acid azotic fumans, hidroxid de sodiu topit, permanganat de potasiu sau acid cromic. Cu excepția hidroxid de sodiu, acești reactanți reacționează cu alchene, chiar și la temperatura camerei. Pentru cei câteva dintre reacțiile la care sunt capabile de alcani, este necesar să se aplice condiții stricte, cum ar fi temperaturi ridicate sau catalizatori specifici.
În prezent,
90% alcani produse din petrol sunt arse drept combustibil în motoarele cu ardere internă și centrale electrice. Acest lucru este inacceptabil de mult ca Alcanii sunt foarte predispuse la reacții radicale și servesc ca materie primă valoroasă în sinteza organică. Un exemplu de reacție radicală este o reacție de halogenare. Luați în considerare exemplul simple alcani sale reprezentative clorinare - metan.
Clorurarea metanului este un proces industrial important. substituția secvențială a atomilor de hidrogen cu atomi de clor în moleculă conduce la producerea clorurii de metil CH3 CI, CH2-CI2 diclormetan. triclormetan (cloroform) și tetraclorură de carbon CHCl3 (tetraclorură de carbon) CCl4. Toate cele patru produse sunt o aplicație importantă în sinteza organică, în special (cu excepția clormetan) ca solvenți.
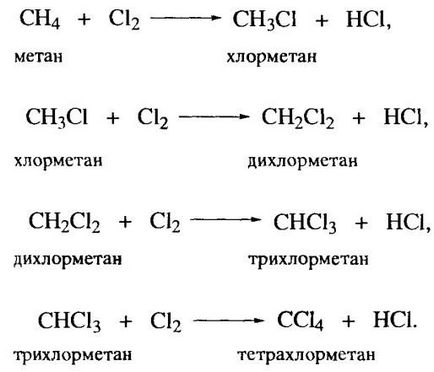
În clorurarea termică continuă, în general, în fază gazoasă, scindarea moleculei de clor se realizează la temperaturi suficient de ridicate (250-450 ° C). clorurarea fotochimica poate fi efectuată la temperatura camerei; în timp ce cel mai eficient lumina este lumina cu o lungime de undă de 340 nm care corespunde absorbției maxime a clorului. La aplicarea unui inițiatori de reacție radical de clorurare se realizează la temperaturi moderate (80-100 ° C).
Clorurarea metanului procedează ca proces în lanț radical, deoarece clorul atomic implicat în circuitul de faza de dezvoltare, din nou, format în etapa ulterioară. Circuit Limbo (inițiere). care constă în formarea de atomi de clor liber se poate realizată prin mai multe metode: termic, fotochimic și folosind inițiatori.
Dezvăluie Mecanismul de reacție are loc într-o secvență de schimbări elementare în timpul moleculelor care reacționează. Acesta este disecat în detaliu modul în care are loc reacția. El trebuie să explice formarea produșilor de reacție și stereochimia lor.
Mai jos, ca exemplu, este reprezentat mecanismul metan de reacție de clorurare.

Căldura de reacție este determinată? H 0 Etapa 2 și 3 (creștere în lanț) și nu include efecte ale nucleatie și cu lanț pașii de terminare.
Astfel, clorurarea metanului este o reacție exotermă și se continuă cu eliberarea unei cantități considerabile de căldură.
etapa Skorostlimitiruyuschey, adică etapa de determinare a vitezei unei reacții chimice în etapa de clorurare 2 este metan; aceasta corespunde PS1 stare de tranziție. Ca stare de tranziție organică a reacției poate fi studiată prin metode fizico-chimice convenționale, în cazul general trebuie să simuleze sau pornind de reactivi sau compuși intermediari sau produse finale. Cel mai bun model de particule PS vin la această stare de tranziție de energie. Această prevedere este cunoscută sub numele de postulatul Hammond.
Formal liber radical metil are o structură tetraedrică.
Cu toate acestea, din cauza mică inversare magnitudinea barierei (forma de tranziție o moleculă la alta), este cel mai probabil statistic structura planară a moleculei de metan, adică Toate cele 4 atomi se află în același plan.
Ce argumente suplimentare în favoarea mecanismului radical cunoscut de clorurare metanului cu excepția faptului că această reacție este inițiată de radiațiile UV? Se poate observa, cel puțin două fapte, confirmând implicarea radicalilor în reacție.
- Reacția este încetinită prin adăugarea de oxigen la amestecul de reacție, deoarece această radicali alchil activi sunt transformați în radicali alkylperoxide inactive RO2.
Oxigenul, tind să favorizeze un inhibitor al reacțiilor radicalilor (reacție chimică încetinește).
- Dimpotrivă, inițiatorii reacțiilor radicalilor accelerează clorurarea metanului. Ea are această proprietate, în special tetraetil de plumb, cu formarea de radicali etil ușor degradabile.
Etil radical stă în care caz un inițiator de reacție radical.
Omologii clorurare radicali liberi metana.Ustoychivost
În ceea ce privește Omologii de metan și radicalii lor crește stabilitatea în radicalii serie metil, etil, izopropil și terț-butil:
datorită delocalizare de electroni nepereche (densitate de spin), cu participarea grupărilor metil legat la centrul radical.
rezistență diferită formate intermediately radicali alchil definește activitatea relativă a legăturii CH terțiară, primară și secundară în alcani. De exemplu, activitatea relativă a legăturilor C-H primară și secundară sunt egale cu 4: 1. Acest lucru are ca rezultat faptul că reacția are loc în mod avantajos, cu formarea de 2-clorpropan (randament = 57%)
reacția Clorurarea propan la 25 ° C, astfel, fluxurile regioselectiv. reacția regioselectivă - aceasta este o astfel de reacție, în timpul căreia suferă schimbări chimice predominant una din două sau mai multe dintre dispozițiile moleculei de reactiv.
Reacțiile regioselectivă sunt extrem de frecvente în chimia organică. Să ne, prin urmare, mai mult pe definirea lor. În primul rând, evaluarea ar trebui să ia în considerare factorul statistic regioselectivitate. În plus, în comparație centrele de reacție trebuie să aibă aceeași natură chimică. Reacțiile sunt numite în totalitate (100%) regioselectivă dacă schimbarea este supusă doar o singură poziție. Reaction numita (X%) regioselectivă parțială dacă schimbarea uneia poziție prevalează asupra altor prevederi. Diferența poate fi efectuată la un nivel semicantitativă și pentru a distinge regioselectivitate înaltă și joasă. propusă anterior termenul „regiospecificității“ pentru regioselectivității 100%. În prezent, nu este recomandată din cauza conflictului cu termenii „stereoselective“ și „stereospecificitate“.
Este important să se sublinieze că activitatea relativă a legăturilor C-H din alcani, inclusiv atunci când clorinarea, în mare măsură, depinde de temperatura. În particular, clorinarea propan la 450 ° C, dă următoarea distribuție izomer:
În acest caz, activitatea legăturilor C-H primare și secundare sunt ambii 1: 1.
reacție de adiție cu clor, alcani poate reacționa cu alți halogeni, ca printr-un mecanism cu lanț radical, în care compoziția produșilor de reacție se determină radicali alchil nu numai de stabilitate relativă care formează intermediately, dar, de asemenea, activitatea unui atom de halogen, o molecula de alcan atacator.
Nitrarea alcani pentru prima dată petrecut MI acțiune Konovalov acid azotic de 10-20% la -lea 120-150 ° C (reacție Konovalov 1888 YG). În prezent, mai multe sisteme cunoscute nitrarea industriale alcanilor: în fază lichidă la 100-150 ° C și în faza gazoasă, la 350-500 ° C Concentrația acidului azotic variază între 40-70%.
Mecanismul acestei reacții - radical liber:
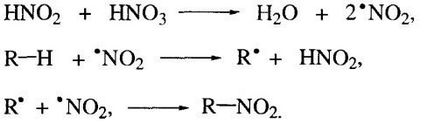
Intr-un acid azotic mai concentrat (60-70%) • NO2 sursă radical poate fi acid azotic și descompunerea moleculei HNO3.
alcani azotați în fază lichidă sau gazoasă, cu dioxid de azot dimer N2 O4.
Spre deosebire de halogenare radical liber nu este continuă nitrare prin intermediul unui mecanism de lanț: în faza de formare a compusului nitro nu reia oricare dintre radicalii liberi intermediari (nu mai apare în pasul următor). Cu toate acestea, la fel ca în cazul altor reacții de radicali liberi de alcani, compoziția produselor de nitrare a determinat, de asemenea, capacitatea diferitelor legături C-H la ruptura homolitică. Cu toate acestea, spre deosebire de reacțiile de halogenare în timpul reacțiilor nitrare observate adesea decalaj și legături C-C (nitrare distructive).
3. sulfoclorurare de alcani
Sulfoclorurare alcanilor sub iradiere UV la temperatura camerei, se desfășoară ca un proces radical de lanț (reacție Reed 1936 YG). Deoarece produsul astfel obținut cloruri acide alcansulfonici.
Următoarele este mecanismul acestei reacții:
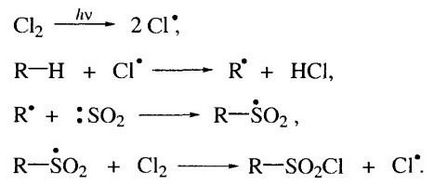
O caracteristică a reacției este faptul că, în prezența unei hidrocarburi într-o moleculă de atomi de carbon primar, secundar și terțiar nu sunt supuse înlocuirea atomilor de hidrogen cu atomul de carbon terțiar.
Se crede că motivul pentru această reacție particulară sunt împiedicate steric abordare reactiv voluminos la atomul de carbon terțiar.
Oxidarea alcani și veniturilor printr-un mecanism radical și poate fi completă (pentru a forma dioxid de carbon și apă):
sau parțial (pentru a forma CO sau carbon elementar):
Amestecurile produse în oxidarea parțială a metanului, acesta trebuie luat în considerare materia primă cea mai promițătoare pentru producerea alcanii sintetice la scară industrială.
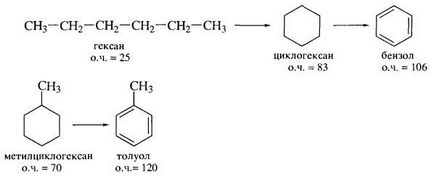
Un exemplu de oxidarea completă a alcanilor este utilizarea lor drept combustibil pentru centralele termice și utilizarea fracțiunilor de benzină în motoarele cu ardere internă. In acest ultim caz, ramificat alcani ca alcani liniare în motoarele exploda (detona)!
Proprietăți benzină octane caracterizează (O.Ch.). În acest caz, se presupune că 2,2,4trimetilpentan (izooctan), unul dintre izomerii octanice, are o cifră octanică egal cu 100, și n-heptan - cifra octanică de la zero. Cifra octanică a benzinei este egal cu orice conținut (în% vol.) Într-un amestec de trimetilpentan „trimetilpentan - n-heptan“, care are aceleași proprietăți de detonare la benzina de testare.
Oxidarea parțială a alcanilor
Acesta este utilizat într-o scară mai limitată pentru a produce unele oxigenați. Prin oxidarea controlată a uleiurilor minerale cu punct de fierbere a aerului și parafine recuperate din uleiul format un amestec de acizi carboxilici superioare adecvați pentru fabricarea detergenților.
Sulfoxidation alcanilor prin iradiere UV are loc, de asemenea, ca proces radical liber:
Trebuie remarcat reacții speciale importanță sulfoclorurare și sulfoxidation pentru producerea de acizi alcansulfonici având diverse utilizări, inclusiv ca detergenți. proprietăți „curatare“ acizi alcansulfonici bazate pe activitatea de suprafață a moleculelor acestor compuși. Având două fragmente în compoziția sa - hidrofobe (rest de alean) și hidrofile (grup sulfo), moleculele de acizi alcansulfonici dobândesc capacitatea de a se orienta la interfața, asigurându-se astfel transferul de poluanți într-o fază apoasă și îndepărtarea acestora din materialul contaminat.
Termoliza are de asemenea natură radical alcani, dar continuă cu formarea de produse diferite în funcție de condițiile.
Prin reacția termică a alcanilor includ, de asemenea cracare și reformare. Așa numitele procese chimice utilizate în industrie pentru rafinarea țițeiului brut. Scopul lor este de a crește randamentul și calitatea fracțiunilor de benzină adecvate pentru utilizare drept carburant.
Supuse la fisurare reziduurilor petroliere fierbere ridicate obținute în distilarea petrolului. In timpul cracării alcanilor cu greutate moleculară mai mare sunt convertite în greutate moleculară mică. Acest lucru se realizează, în special, utilizarea unor temperaturi foarte ridicate - până la 700-900 ° C (cracare termică).
Dezavantajul cracarea termică este că produsele sale nu conțin cantități semnificative de alcani ramificați, prin care utilizarea nu se poate obține un combustibil motor cu o cifră octanică mai mare de 65-70. Cele mai bune rezultate sunt atinse în Schemele de cracare catalitică. Aceasta se realizează cu utilizarea unui catalizator aluminosilicat (tip zeolit Y) și la temperaturi mai moderate (400-450 ° C).
Chiar proces mai eficient producerea de combustibil pentru motor, cu un număr maxim octanică este de reformare. Acest proces este conceput pentru a converti alcanii medii liniare și cicloalcani la hidrocarburi aromatice mai mult.
Spre deosebire de cracare catalitică, care se realizează în catalizatorii de tip acid din procesele reformatoare folosesc catalizatori heterogene deshidratante. Dacă se utilizează în catalizatori un proces de reformare platinorenievye, acest proces este numit platforming.
Metode catalitice de reciclare a fracțiunilor petroliere fundamenta producția hidrocarburilor de alimentare pentru sinteza organică industrială.
Predilecției alcan reacțiilor radicalilor doar limitează semnificativ posibilitatea administrării directe a moleculelor de diferite grupări funcționale. Prin urmare, chimiști eforturile care vizează găsirea unor noi reacții de alcani. De exemplu, au fost deschise reacții ionice.
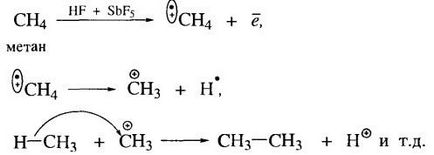
alcanii medii cu potențiale de ionizare mai mici, sunt capabile de carbocationilor profilaț.un sunt supuse izomerizare și oligomerizarea sub acțiunea acizilor Lewis puternici.
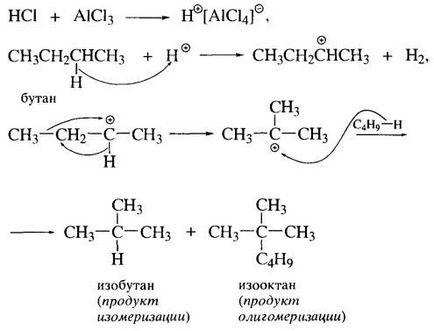
Forța motrice a rearanjarea carbocationului terțiare este diferența în stabilitatea lor: tertiar are cele mai bune condiții pentru delocalizarea sarcinii pozitive.