Solubilitatea substanțelor în apă
Numita soluție stabilă termodinamic unui produs omogen (monofazat) alternativ soclu sistem format din două sau mai multe componente (produse chimice). Componentele care constituie soluția, sunt solventul și solutului. În mod tipic, componentul este considerat a fi un solvent care există în forma sa pură, în aceeași stare agregat, iar soluția rezultată (de exemplu, în cazul unui solvent apos este o soluție de sare, desigur, apă). Dacă ambele componente au fost să se dizolve într-o stare similară de agregare (de exemplu, alcool și apă), apoi solventul este considerat componentele situate în sumă mai mare.
Soluțiile sunt lichide, solide și gazoase.
Soluțiile lichide - este soluțiile de sare, alcool de zahăr în apă. Soluțiile lichide pot fi apoase și neapoase. Soluțiile apoase - sunt soluții în care solventul este apa. soluții neapoase - sunt soluții în care solvenții sunt lichizi organici (benzen, alcool, eter, etc.). Soluțiile solide - aliaje metalice. soluții gazosi - aer și alte amestecuri de gaze.
Procesul de dizolvare. Dizolvarea - un proces fizico-chimic complex. Dacă procesul fizic este distrugerea structurii solutului și distribuția particulelor între moleculele de solvent. Procesul chimic - o reacție cu molecule de solvent ale particulelor de solut. Ca urmare a acestei interacțiuni se formează solvați. Dacă solventul este apa, solvatul format este numit hidrați. Procesul de formare a solvaților este numit solvatare, formarea hidraților - hidratare. Prin evaporarea soluției formate hidrații apoase cristaline - sunt substanțe cristaline, care includ un anumit număr de molecule de apă (apă de cristalizare). Exemple de cristalin: CuSO4. 5H2 O - sulfat de cupru (II); FeSO4. 7H2O - sulfat de fier heptahidrat (II).
Procesul fizic de dizolvare merge cu absorbția energiei, chimice - cu eliberare. În cazul în care, ca urmare a hidratării (solvatare) produce mai multă energie decât este absorbită în distrugerea structurii materiei, dizolvarea - procesul exoterm. Eliberarea de energie are loc prin dizolvarea NaOH, H2 SO4. CO3 Na2. ZnSO4 și alte substanțe. În cazul în care distrugerea structurii materiei are nevoie de mai multă energie decât este eliberată în timpul hidratării, dizolvarea - endotermic. Absorbția energiei are loc atunci când este dizolvat în NaNO3 apă. KCI, NH4 NO3. K2 SO4. NH4Cl și alte substanțe.
Cantitatea de energie care este eliberată sau absorbită prin dizolvare, se numește efect termic dizolvarea.
Soluți numit capacitatea sa de a fi distribuite într-o altă substanță sub formă de atomi, ioni sau molecule pentru a forma compoziția stabilă termodinamic a variabilei de sistem. O caracteristică cantitativă este coeficientul de solubilitate al solubilității. care indică ce masa maximă a substanței poate fi dizolvat în 1000 sau 100 de grame de apă la o temperatură dată. Solubilitatea unei substanțe depinde de natura solventului și substanța de temperatură și presiune (pentru gaze). Solubilitatea substanțelor solide în general crește cu creșterea temperaturii. Solubilitatea gazelor scade odată cu creșterea temperaturii, dar crește cu o presiune tot mai mare.
Pentru substanțele solubile în apă sunt împărțite în trei grupe:
2. rar (m.). Agenții de solubilitate de la 0,01 g până la 10 g la 1000 g de apă. De exemplu, 2 g de gips (CaSO4. 2 H2O) dizolvat în 1000 g de apă.
3. Practic insolubil (n.). Solubilitatea substanțelor este mai mică de 0,01 g în 1000 g apă. De exemplu, în 1000 g de apă se dizolvă 1.5. 10 -3 g AgCl.
Când substanțele dizolvate pot forma saturate, nesaturate și soluții suprasaturate.
Soluție saturată - o soluție care conține cantitatea maximă de substanță dizolvată în condițiile date. Prin adăugarea o astfel de substanță în soluție nu mai era substanță solubilă.
soluție Nesaturați - o soluție care conține substanța dizolvată este mai mică decât saturat la condițiile date. Prin adăugarea o astfel de substanță într-o soluție de substanță sa dizolvat.
Uneori este posibil să se obțină o soluție în care solutului este conținut mai mult decât într-o soluție saturată la o temperatură dată. O astfel de soluție se numește suprasaturată. Această soluție a fost preparată prin răcirea lentă a unei soluții saturate la temperatura camerei. Soluții suprasaturat sunt foarte instabile. substanță Cristalizarea într-o astfel de soluție poate provoca frecare cu o baghetă de sticlă de pereții vasului în care soluția activă. Această metodă este utilizată la efectuarea unor reacții calitative.
Solubilitatea substanței poate fi exprimată și concentrația sa molară a unei soluții saturate (2.2).
constantă solubilitate. Considerăm că procesele care au loc în interacțiunea unei moderație, dar BaSO 4 electrolit tare sulfat de bariu cu apă. Sub acțiunea dipolilor de apă și ionii Ba 2+ SO4 2 - BaSO4 din rețeaua cristalină se va muta în faza lichidă. Concomitent cu acest proces, sub influența câmpului electrostatic al cristalului porțiunii zăbrele Ba 2+ ionul și SO4 2 - vor fi re-depuse (Fig.3). La această temperatură într-un sistem eterogen, în cele din urmă, se stabilește echilibrul: viteza de dizolvare a procesului (V1) este egală cu viteza procesului de depunere (V2), adică
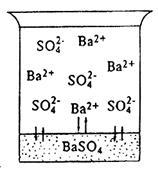
Fig. 3. O soluție de sulfat de bariu saturată
Soluția care se află în echilibru cu BaSO 4 fază solidă. Se numește saturată cu privire la sulfatul de bariu.
Soluția saturată este un sistem eterogen de echilibru, care se caracterizează prin constanta de echilibru chimic:
în care o (Ba 2+) - ionii Activitate bariu; un (SO4 2-) - Activitatea ionilor sulfat;
a (BaSO4) - Activitatea molecule de sulfat de bariu.
Numitorul acestei fracțiuni - Activitatea BaSO4 cristalină - este o constantă egală cu unitatea. Produsul a două constante conferă o nouă valoare constantă, care se numește termodinamic și solubilitate Ks constantă denote °:
Această valoare este folosită pentru a fi numit produsul de solubilitate și este o dreaptă.
Astfel, puțin solubil într-o soluție saturată de o puternică activitate de echilibru produs electrolitic al ionilor săi este constantă la o temperatură dată.
Presupunând că un electrolit greu solubil saturate activitate soluție coeficient f
1, activitatea ionilor în acest caz, poate fi înlocuit cu concentrațiile acestora, precum și (X) = f (X). C (X). Solubilitatea termodinamic constantă Ks ° intră concentrația Ks constantă de solubilitate:
unde C (Ba 2+) și C (2 SO4 -) - concentrația de echilibru a Ba 2+ ioni și SO4 2 - (mol / l) într-o soluție saturată de sulfat de bariu.
Pentru a simplifica calculele sunt, de obicei concentrația Ks constante de solubilitate. f Luând (X) = 1 (Anexa 2).
Dacă electrolitul puternic formează un greu solubil după disocierea unor ioni in expresie Ks (Ks sau °) sunt măsură corespunzătoare egale cu raporturile stoechiometrice:
În general, expresia unei concentrații constante de solubilitate electrolit Sunt Bn # 8644; m A n + + n B m - are forma
unde C - concentrația ionilor A n + și B m - într-o soluție de electrolit saturată în mol / l.
Valoarea Ks luate pentru a utiliza numai în ceea ce privește electroliți a căror solubilitate în apă nu depășește 0,01 mol / litru.
Condițiile de formare a precipitațiilor
Să presupunem, cu - concentrația reală ion solubilă dificilă în soluția de electrolit.
Dacă C m (A n +). C n (B m -)> Ks. se va precipita, din moment ce soluția devine suprasaturată.
Dacă C m (A n +). C n (B m -) Proprietățile soluțiilor. Mai jos avem în vedere proprietățile soluțiilor de non-electroliti. În cazul electroliți în formula de mai sus este administrată coeficient corector izotonic. Dacă se dizolvă într-o substanță non-volatilă lichid, presiunea vaporilor deasupra soluției este mai mică decât presiunea de vapori de peste solventul pur. Concomitent cu se observă o schimbare de la punctul său de fierbere și de congelare scăderea presiunii vaporilor deasupra soluției; soluții de fierbere creșterea temperaturii, și temperaturi de îngheț picătură în comparație cu temperaturile ce caracterizează solvenții puri. Relativa scădere a temperaturii de congelare sau creșterea relativă la temperatura de fierbere a soluției este proporțională cu concentrația acestuia: unde K - constanta (cryoscopic sau ebulioskopicheskaya); Cm - concentrația molal a soluției în mol / 1000 g de solvent. Deoarece Cm = m / M, unde m - masa substanței (g) în 1000 g de solvent M - masa molară, ecuația de mai sus se poate scrie: ; . Astfel, cunoscând valoarea pentru fiecare solvent Prin specificarea m și experimental determinarea # 8710; t în aparat sunt M solut. masa molara a solutului poate fi determinată prin măsurarea presiunii osmotice a soluției (π) și se calculează prin ecuația Van't - Hoff: ; .