Lecția 12
În Lecția 12, „ecuațiile de scriere de reacții chimice“ desigur „Chimie pentru Dummies“ noi învățăm să facem ecuația reacțiilor chimice și corect stabilite în coeficienții lor.

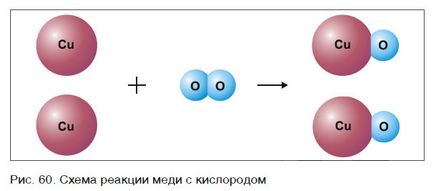
Fii ecuații chimice și de a efectua calcule pe ele au nevoie, în baza legii conservării masei în reacțiile chimice ale substanțelor. Luați în considerare modul de a face ecuații chimice, exemplul reacției cuprului cu oxigen.
De la stânga pentru a scrie numele materiilor prime, în dreapta - produsele de reacție. În cazul în care două sau mai multe substanțe, conectați lor semnul „+“. Între laturile din stânga și din dreapta săgeții până când dă:
+ Oxigen → compus de cupru din cupru cu oxigen.
O astfel de expresie se numește o schemă de reacție chimică. Scriem acest circuit prin formule chimice:
Numărul de atomi de oxigen în partea stângă a circuitului este egal cu doi, iar dreapta - una. Deoarece atomii nu dispar când reacțiile chimice și rearanjarea are loc doar le, numărul de atomi din fiecare element de reacție și după reacție trebuie să fie identice. Pentru egalizarea numărul atomilor de oxigen în părțile din stânga și din dreapta ale circuitului, înainte de a formula coeficientului de CuO set 2:
Acum, numărul de atomi de cupru după reacție (partea dreapta a schemei) este de două, și înainte de reacția (în partea stângă a diagramei) - numai unul, deci înainte de a formula cupru Cu asemenea, de aprovizionare factor 2. Rezultatul acestei acțiuni numărul de atomi din fiecare tip de stânga și laturi drepte ale aceluiași sistem, ceea ce ne dă un motiv pentru a înlocui săgeata de pe semnul „=“ (egal). Schema a evoluat în ecuația reacției chimice:
Această ecuație se spune: Kuprum doi plus doi este egal cu aproximativ două Kuprum-on (figura 60.).
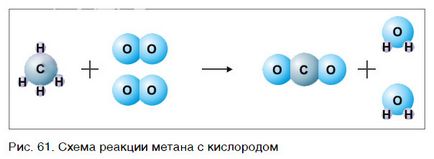
Să considerăm un alt exemplu al unei reacții chimice între substanțele CH4 (metan) și oxigen. Formează schema de reacție, în care a lăsat formula metan scrie și oxigen, și dreapta - a produselor de reacție cu formula - compuși de apă și de carbon cu oxigen (dioxid de carbon):
Observați că în partea stângă a schemei de numărul de atomi de carbon egal cu numărul lor de pe partea dreaptă. Prin urmare, necesitatea de a egaliza numărul atomilor de hidrogen și oxigen. Pentru egalizarea numărul atomilor de hidrogen la rata de alimentare cu apă formula 2:
Acum, numărul de atomi de hidrogen devin dreapta 2 x 2 = 4 și din stânga - patru. În continuare, se calculează numărul de atomi de oxigen în partea dreaptă a schemei: doi atomi de oxigen într-o moleculă de dioxid de carbon (1 x 2 = 2) și atomii doi oxigen la două molecule de apă (2 x 1 = 2), un total de 2 + 2 = 4. În diagramele laterale stânga, doar doi atomi de oxigen în molecula de oxigen. Pentru a egaliza numărul de atomi de oxigen, 2 pentru a furniza coeficientul de oxigen cu formula:
Ca urmare a acțiunilor de numărul de atomi de elemente chimice până când reacția este egal cu numărul lor după reacția. O ecuație este făcută. Se citește după cum urmează: tse-el-patru plus doi este egal cu aproximativ două tse-on-doi și doi al-doi-oh (Figura 61.).
Această metodă de dispunere se numește metoda coeficienților de selecție.
În chimie există și alte metode de a egaliza numărul de atomi de elemente din partea stângă și dreaptă ale ecuațiilor reacțiilor cu care vom introduce mai târziu.
Concluzii scurtă lecție:
Pentru a compila ecuațiile reacțiilor chimice trebuie urmate procedura următoare.
- Pentru a stabili compoziția materiilor prime și a produselor de reacție.
- Se înregistrează materiile prime cu formula la stânga, produsele de reacție - dreapta.
- Între partea stângă și dreaptă ale ecuației pus prima săgeată.
- Coeficienții puncționare r. E. Pentru egalizarea numărul de atomi din fiecare element chimic înainte și după reacție.
- Alocați partea stanga si dreapta a semnului ecuația „=“ (egal).